手性胺结构存在于近40%的药物中,其高效和选择性合成在医药和精细化学品领域具有重要意义。然而,传统化学方法在构建手性胺结构时通常需经过多步保护/脱保护操作,且在底物适应性和立体选择性方面存在一定局限。
酶作为一类天然的手性催化剂,在控制立体选择性方面有着独特的优势。近年来,随着定向进化技术的迅速发展,越来越多的酶催化手性合成策略被报道。L-苏氨酸醛缩酶(L-Threonine Aldolases, LTAs)是一类典型的5-磷酸吡哆醛(PLP)依赖的缩合酶,该类酶天然利用甘氨酸、丙氨酸和苏氨酸作为供体,通过碳碳键形成构建手性氨基酸衍生物。该反应过程依赖于底物和酶口袋中的赖氨酸缩合,经过脱质子形成关键的富电子中间体Quinonoid,作为亲核试剂参与反应。然而,天然LTA仅能活化体积较小的氨基酸底物,近期的光酶催化非天然反应也只能局限于氨基酸衍生物的合成,限制了其在合成更广泛手性胺类化合物中的应用。
近日,普林斯顿大学Todd Hyster课题组在J. Am. Chem. Soc.发表研究,通过定向进化改造LTA,使其能够催化非天然底物——苯甲胺类化合物——与醛发生缩合,合成一系列具有高对映选择性和非对映选择性的1,2-氨基醇衍生物(图1)。这是Hyster课题在苏氨酸醛缩酶方向的又一重要突破(此前工作:J. Am. Chem. Soc. 2024, 146, 13754–13759,点击阅读详细)。本研究中,他们通过酶学和晶体结构研究揭示了关键突变位点如何重塑底物结合口袋,从而实现对普通胺类底物的高效识别与转化。更具启发性的是,研究团队通过结构设计将活性位点迁移至另一种天然不具此功能的PLP依赖酶中,成功实现功能嫁接,进一步验证了该策略的可迁移性与普适性。
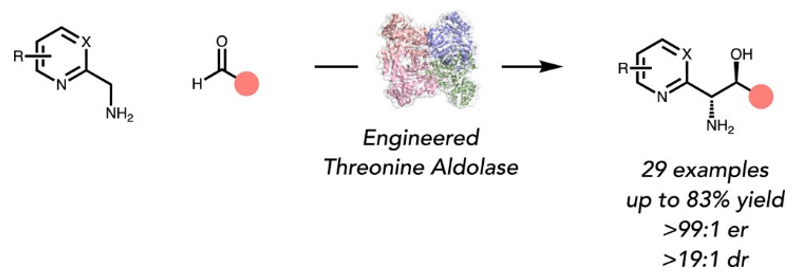
图1. 反应概述。图片来源:JACS
该研究提出一种全新设想:醛缩酶不仅限于氨基酸类底物,其活性中心可经工程化改造,以适配普通一级胺,实现无需保护/脱保护操作,一步构建1,2-氨基醇骨架。此方法以市售胺和醛为原料,为手性胺和氨基醇类化合物的高效合成提供了有力工具,展现了酶催化合成方法在精细有机合成领域的广阔前景。
在该研究中,作者从LTAs 家族中选择了Thermotoga maritima 来源的热稳定酶TmLTA作为反应的起始催化剂。以2-(氨甲基)吡啶作为Quinonoid 供体,3-苯丙醛作为受体,在0.1 mol%的酶催化下,野生型的TmLTA得到了9%的产率和优异的立体选择性。借助PDB的晶体结构(PDB: 1LW5),研究团队围绕酶口袋中关键氨基酸残基进行四轮定向进化,分别引进了N308E、Y87A、P121D和R122G突变(TmLTAEAGD)。最终的突变体在0.1mol%的浓度下给出了83%的产率和近乎完美的立体选择性(图2)。为了验证该系统的应用潜力,作者采用细胞裂解液的冻干粉作为催化剂,在13 wt%的蛋白浓度下,突变体仍保持优异的选择性,凸显其实用性。进一步研究发现,该突变体仍可接受甘氨酸作为aldol供体,说明其对天然底物中羧酸基团的结合能力未丧失。值得注意的是,所得1,2-氨基醇产物在该条件下表现出极低的逆反应倾向,可能解释了该体系中远超天然反应的非对映选择性。
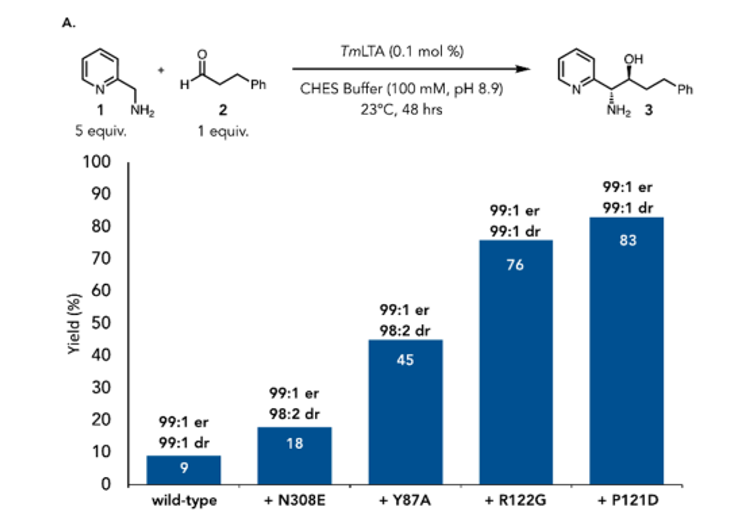
图2. 酶的定向改造和优化。图片来源:JACS
利用最优突变体TmLTAEAGD,作者探索了各种不同结构的杂环胺和醛的反应性和局限性(图3)。在 3′−6′ 位上带有 Cl(4、7、9、10)、F(6 和 11)和 Me(5 和 8)取代基的吡啶相容性良好,产率为 21%−69%,立体选择性近乎完美(er > 99:1 和dr > 99:1)。3-Cl 和 F 取代基的反应性降低,这可能是由 F 和 Cl 的电子和空间效应导致的,而当将限制试剂反转为胺时,反应性适度提升。此外,该突变体也能接受甘氨酰胺12(一种与野生型TmLTA不反应的胺),而酰胺的pKa(35,DMSO)高于羧酸盐(pKa = 29.5),这表明酶的定向进化选择了对惰性底物具有活性的突变体。鉴于TmLTAEAGD保留了对天然底物的催化活性,表明蛋白质工程使该酶从一种专一性酶变成了多功能性酶,并拓宽了其合成用途。作者发现,骨架各异的杂环化合物(13-17)均表现出不同的反应性。第一轮变体TmLTA-N308E使嘧啶(14)的产量翻倍,且保留了立体选择性。此外,常见的杂环,比如噻唑(15)、咪唑(16)和苯并咪唑(17)均可兼容该反应条件,并得到优异的对映和非对映选择性。
TmLTAEAGD还可耐受多种醛类底物。甲醛(18)具有30%的产率和完美的对映选择性。该酶也可接受炔基醛(19),为后续的生物正交点击反应提供了潜在前体。带有前立体中心的外消旋底物(20和26)也能被转化,所得产物的非对映选择性较低(2.3:1和2.2:1),显示出一定的动力学拆分特征。此外,在药物化学中常见的氮杂环丁烷和氮杂螺环结构也能顺利反应(21和22的分离产率分别是46%和48%)。2-羟基四氢呋喃可反应得到1,4-二醇产物(23),α-苯基取代的底物因空间位阻(24和25)产率较低。值得一提的是,该酶也能接受未保护的核苷酸类似物(27)。这类结构很难通过其他合成方法获得,进一步突显了该方法的优势。所得到的1,2-氨基醇产物可以进一步转化为对映纯的氮丙啶,或发生环化得到噁唑烷-2-酮等。考虑到醛在空气中容易发生自氧化,作者引入FAD依赖的胆碱氧化酶AcCO6实现醇的原位氧化,并与LTA酶串联形成一锅反应流程。该级联体系可在65%产率下获得主产物,立体选择性依然优异。
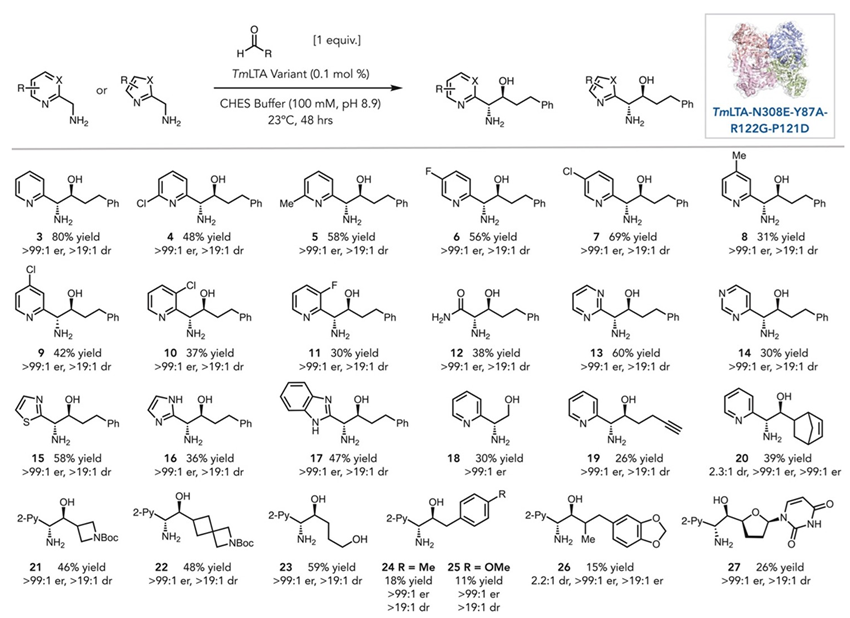
图3. 反应的底物适用范围。图片来源:JACS
最后,作者对反应机理进行了深入探索(图4)。首先,作者利用紫外可见吸收光谱对反应中的关键中间体Quinonoid进行了表征。已知在以氨基酸为aldol供体的反应中,Quinonoid为一个相对稳定的富电子中间体,能够有效与醛类底物发生C–C键形成反应。作者推测,突变体反应性能的提升,部分来源于Quinonoid中间体的形成能力增强。当将 2-氨基甲基吡啶 1 添加到野生型 TmLTA 中时,观察到较弱的吸收(λmax = 567 nm),作者推测形成了杂环Quinonoid中间体(图4A)。与源自甘氨酸或丙氨酸的Quinonoid相比(λmax = 497 nm),此特征显著红移,可能是因为氨基甲基吡啶和酶形成的Quinonoid共轭作用增强。当对 TmLTA-N308E 进行相同实验时,此特征的强度增加了 10 倍。这一趋势在TmLTA-N308E-Y87A-R122G的进化序列中持续存在,与野生型蛋白相比,其强度增加了19倍。这一现象支持了作者的假设,即突变增加了反应中亲核性Quinonoid的浓度。该中间体的浓度在1小时内逐步下降,伴随330nm处出现新的吸收特征,作者将其归因于吡哆胺和2-吡啶甲醛的形成,这表明在没有醛类底物的情况下,可能发现缓慢的转氨基反应。
为了进一步了解结构变化对酶性能的影响,作者解析了最终突变体TmLTAEAGD以及和底物的共晶体结构。对所得晶体进行X射线衍射分析,突变体(PDB:9E97)与野生型(PDB:1LW5)高度相似,但关键残基R316在结构中向N308E方向移动了近1.6 Å,这一位移引入了氢键作用,使活性位点的侧链移动,为体积更大的杂环底物能够顺利结合。在酶和底物的共晶结构中 (PDB: 9E9J) 观察到了类似的氢键作用。有趣的是,底物中的吡啶基团没有在活性位点内形成额外的氢键作用。此外,Y87A 突变增加了活性位点的空间大小,从而增强了胺类底物的反应效率(图4B)。
基于R316侧链的移动对于非氨基酸类底物的活性至关重要这一假设,作者研究了该位置突变对其他类胺类底物转化活性的影响。作者提出猜想,该位置突变可能会使其与相对惰性的苄胺发生反应。野生型TmLTA和TmLTAEAGD均无法转化苄胺。引入单点突变后,TmLTAEAGD-R316A得到了较低催化活性(6%的产率),而TmLTAEAGD-R316W进一步提高产率至15%(图4C)。作者认为R316W突变体反应性能的提高是由于芳烃和吲哚之间的π-π相互作用。该变体对其他缺电子苄胺(29和30)均有效,这一结构–功能关系的研究不仅深化了对LTA底物范围可调控性的理解,也为设计具有新型胺底物活性的PLP依赖酶提供了范式。
在本研究的最后阶段,作者进一步探讨了该酶工程策略在其他PLP依赖酶中的可迁移性,以验证是否可通过类似突变扩展其他酶对非天然底物的识别能力。紫外-可见光谱研究表明,N308E突变在增强酶对杂芳胺底物(如2-氨基甲基吡啶)的识别与催化活性中起到了关键作用(图4A)。基于这一发现,作者提出假设:该突变位点可作为通用策略引入至其他类型I PLP依赖酶中,从而赋予它们对杂环胺类底物的催化潜能。为验证该设想,作者选取了PLP依赖酶UstD2.0作为测试模型。该酶与TmLTA序列相似性不足15%,且天然对2-氨基甲基吡啶底物无反应活性,是验证突变策略可行性的理想对象。通过基于结构的序列比对,作者鉴定出T388为UstD2.0中对应TmLTA-N308的位置。当该位点突变为谷氨酸(T388E)后,获得了初步反应活性——产率为15%,并保持>99:1的对映选择性和非对映选择性。进一步在UstD2.0的M393位点引入TmLTA中Y87A的等效突变(M393A),得到双突变体T388E–M393A,产率为12%,立体选择性保持不变(图4D)。这一结果清晰地验证了TmLTA突变策略在序列相似度低的PLP酶中依然有效。
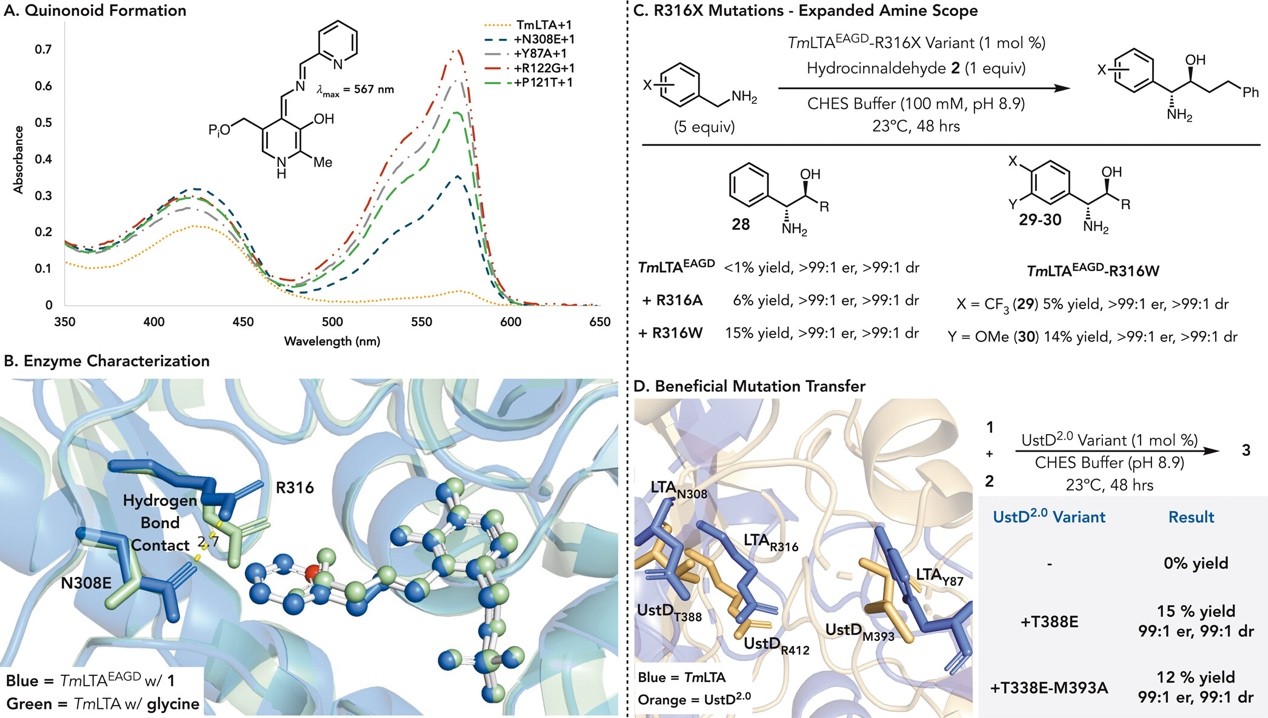
图4. 机理研究。图片来源:JACS
综上所述,Hyster团队成功发现并改造了L-苏氨酸醛缩酶,赋予其识别和活化多种非氨基酸类胺底物的能力,从而实现了对杂环氨基醇的高选择性合成。通过定向进化获得的突变体展现出优异的立体控制能力,并展现出广泛底物适应性,具备作为通用胺类活化平台的潜力。系统的机理研究揭示了关键突变如何重塑酶的底物识别与催化机制,赋予酶新的功能。同时,突变策略在低序列同源性PLP酶中的成功迁移,进一步验证了该方法的可推广性与通用性。本研究不仅拓宽了LTA酶的应用范围,也为PLP依赖酶在复杂胺类化合物合成中的理性设计与功能拓展提供了新思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nucleophilic 𝛼-Functionalization of Benzyl Amines Using an Engineered Threonine Aldolase
Yao Ouyang, Suhao Wang, Damien Sorigue, and Todd K. Hyster*
J. Am. Chem. Soc. 2025, 10.1021/jacs.5c04098