膜内丝氨酸蛋白酶的构象选择催化机理
作者:X-MOL 2025-07-20
蛋白酶是生物体进化出来用于提高生物体内生化反应过程的高效催化剂,不仅在我们的生产生活中产生重要的经济价值,其在生物体内的功能的异常会造成一系列的功能紊乱,因此也是众多疾病治疗的药物靶点。
膜内蛋白酶是一类可以在生物膜内识别和切割跨膜底物的特殊蛋白酶,在生物体内一系列跨膜信号转导过程中发挥重要功能。生物膜是由高疏水性的磷脂双分子层和蛋白等成分组成的复杂体系,阻碍了人们对膜内蛋白酶水解机理的探索。近日,中国科学技术大学史朝为教授团队使用固体核磁共振技术对典型的膜内蛋白酶EcGlpG识别底物的构象选择机理进行了阐释,相关成果发表于《美国化学会志》(Journal of the American Chemical Society)。
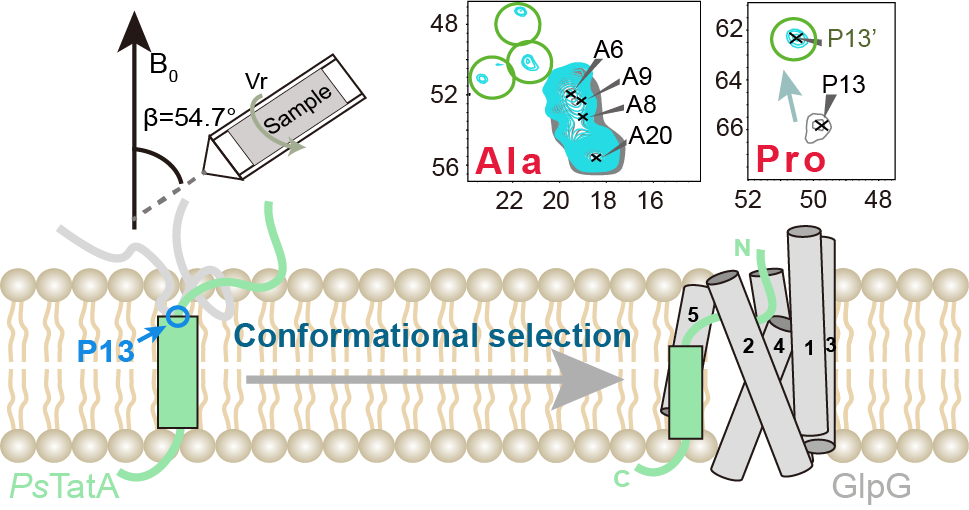
图1. 固体核磁共振研究膜内蛋白酶的构象选择机理
固体核磁共振(solid-state NMR)是近些年正在快速发展的可用于研究复杂体系内生物大分子结构和动态特性的技术,在膜蛋白、纤维蛋白和细胞壁多糖等的研究中被广泛使用。在本研究中,史朝为教授团队针对经典的膜内蛋白酶EcGlpG及其模式底物PsTatA开展了固体核磁共振研究。首先探究了在天然磷脂膜环境下模式底物PsTatA的N端酶切位点附近同时存在多种不同的构象,并以其中一种构象为优势构象,且这些不同的构象都呈现出extended状态。虽然这种构象是一种不稳定的状态,但这降低了酶在识别和切割过程中的能量消耗。其次,当改变磷脂膜的厚度和流动性之后,跨膜底物的优势构象会发生改变,表明了磷脂膜环境对跨膜蛋白构象的调控作用。另外,当膜内蛋白酶EcGlpG被引入之后,同样也会导致跨膜底物的构象发生改变,且变化趋势会受到磷脂膜的厚度和流动性的精确调控。近些年已经有众多关于磷脂分子对膜蛋白功能影响的研究,而且已经有明确的证据证实膜内蛋白酶EcGlpG可以调控膜厚度,基于以上背景信息和本研究中的实验结果,史朝为教授团队提出了一种构象选择机理,即跨膜底物本身处于多种构象交换之中,膜内蛋白酶并不会直接改变跨膜底物的构象,而是通过改变周围的磷脂膜环境,选择出能够被识别的底物构象,进而完成对底物的切割。这种新的构象选择机理将加深人们对磷脂分子在膜内蛋白酶调控方面作用的理解。该课题组博士研究生胡帅飞为论文第一作者,该研究得到基金委及中科院经费支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Conformational Selection Mechanism of Rhomboid-Catalyzed Intramembrane Proteolysis Revealed by Solid-State NMR
Shuaifei Hu, Juan Li, Jin Zhang, Chaowei Shi*
J. Am. Chem. Soc. 2025, 147, 25088–25096, DOI: 10.1021/jacs.5c09134